Presente y futuro de la terapia con radioligandos
- Categorías Endocrinología y Nutrición
- Fecha 13 de febrero de 2023
Dra. Maribel del Olmo. Especialista en Endocrinología y Nutrición. Hospital Universitari i Politècnic La Fe. Valencia / Dra. Amparo García Burillo. Especialista en Medicina Nuclear. Hospital Universitari Vall d’Hebrón. Barcelona.
Dra. Maribel del Olmo / Dra. Amparo García Burillo
La terapia con radioligandos (TRL) es una forma innovadora de terapia oncológica dirigida que utiliza las características específicas de las células tumorales como base para su mecanismo de acción. De este modo, se administran sistemáticamente radiofármacos dirigidos a alteraciones moleculares específicas, expresadas en las células tumorales (órgano diana). Para ello se utilizan moléculas pequeñas marcadas con radioisótopos emisores de partículas beta (177Lutecio, 90Ytrio) o alfa (225Actinio, 213Bismuto, 212Plomo), para dirigir la radiación directamente a dichas células tumorales (efecto determinista) con la mínima toxicidad a los tejidos adyacentes sanos.
En el caso de los tumores neuroendocrinos (TNE), la TRL utiliza una diana molecular, como es el subtipo 2 (SSTR2) del receptor de la somatostatina, que se encuentra sobreexpresado en estas células tumorales. De esta forma, se crea un radiofármaco (un medicamento que emite una pequeña cantidad de radiactividad), dirigido al SSTR2.
Lutecio (177Lu) oxodotreotida, también denominado [177Lu]Lu-DOTA-TATE, es un radiofármaco con triple estructura compuesto por una molécula dirigida contra el tumor, el péptido (DOTA-TATE), que se une al SSTR2; un radioisótopo (177Lutecio; 177Lu); y una parte quelante que une los dos elementos anteriores y que da estabilidad a la molécula1.
En medicina nuclear, los isótopos radioactivos se pueden utilizar tanto para obtención de imágenes como para tratamiento en función de la radiación que emiten. [177Lu]Lu-DOTA-TATE libera a nivel local una radiación β, que provoca la muerte celular de las células tumorales, y una radiación γ que permite la obtención de una imagen, por lo que permite visualizar y tratar la enfermedad en lo que conocemos como teragnosis (terapia + diagnóstico)2.
La Agencia Europea de Medicamentos (EMA), en 2017, y la Agencia del Medicamento de Estados Unidos (FDA), en 2018, aprobaron el uso de [177Lu]Lu-DOTA-TATE para el tratamiento de pacientes con tumores neuroendocrinos gastroenteropancreáticos (TNE-GEP), con expresión de receptores de la somatostatina, bien diferenciados (G1 y G2), progresivos e irresecables o metastásicos3,4. Esta indicación se adquirió a partir del ensayo en fase III NETTER-15, y se ha ido incorporando poco a poco a las guías de práctica clínica habitual.
Más allá de esta indicación, el tratamiento con [177Lu]Lu-DOTA-TATE se puede valorar en otro tipo de tumores (paragangliomas, feocromocitomas, TNE pulmonares…), o incluso en TNE de mayor agresividad biológica (G3) que poseen también la capacidad de expresar SSTR6.
Sin embargo, la expresión de SSTR por parte del tumor puede ser muy variable incluso dentro del mismo individuo, existiendo una gran diversidad en cuanto a la captación de las lesiones. En algunos pacientes encontraremos que algunas lesiones expresarán SSTR, mientras que otras no lo expresarán y, por lo tanto, el tratamiento con RLT siempre deberá abordarse en un comité multidisciplinar en el que se valoren las diferentes opciones terapéuticas, eligiendo la que más se adapte al paciente y a su enfermedad, siendo en muchas ocasiones un verdadero desafío.
Aunque el estudio en fase III NETTER-1 no se realizó hasta 2017, desde hace más de 20 años se han ido realizando ensayos clínicos con 90Y y 177Lu en pacientes con TNE. En todos ellos se observó una gran eficacia del tratamiento, disminuyendo el tamaño tumoral, mejorando los síntomas del paciente y la calidad de vida, así como la supervivencia global, con una aceptable tolerabilidad7-11.
El estudio NETTER-1 fue un estudio fase III internacional multicéntrico, abierto, aleatorizado, en pacientes con TNE de intestino medio, bien diferenciados, metastásicos, con expresión de receptores a la somatostatina, en el que los pacientes fueron tratados con [177Lu]Lu-DOTA-TATE frente a dosis altas de octreotida, cuyo objetivo principal fue la supervivencia libre de progresión (SLP)5.
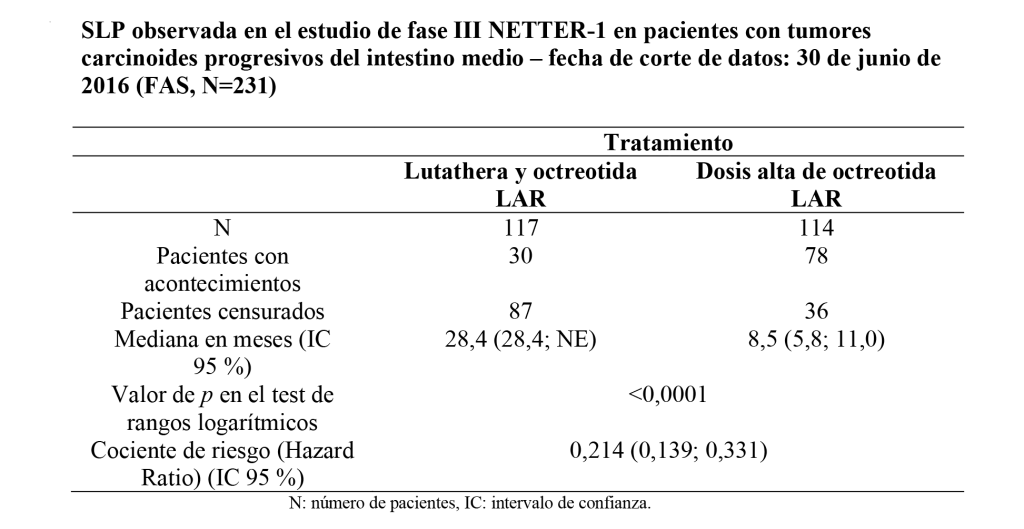
Los resultados mostraron que el brazo control tenía una SLP media de 8,5 meses en comparación con el grupo tratado con [177Lu]Lu-DOTA-TATE, que tenía una SLP de 28,4 meses (ver Tabla 1)5.
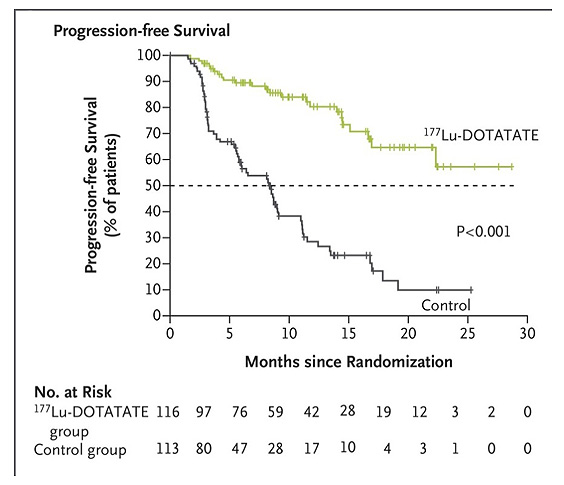
Además, se redujo un 79% el riesgo de progresión o muerte en el grupo [177Lu]Lu-DOTA-TATE, con una toxicidad aceptable (ver Figura 1)5.
En 2021, después de 5 años de seguimiento, se publicaron los resultados de supervivencia global de los pacientes tratados con [177Lu]Lu-DOTA-TATE. En concreto, la supervivencia global de la rama del [177Lu]Lu-DOTA-TATE fue de 48 meses, en comparación con la rama control, que fue de 36 meses. Sin embargo, esta diferencia no fue estadísticamente significativa, probablemente porque hubo un cruce de la rama control a la rama del [177Lu]Lu-DOTA-TATE del 36% de los pacientes a la progresión12.
La evidencia también ha demostrado que, en relación a la calidad de vida, el tratamiento con [177Lu]Lu-DOTA-TATE retrasa el deterioro de la actividad laboral y física; y retrasa la aparición de determinados síntomas relacionados con la enfermedad como la diarrea, el dolor o cansancio13.
Experiencia clínica en el Hospital Universitari La Fe
En el Hospital Universitari i Politècnic La Fe de Valencia se lleva administrando [177Lu]Lu-DOTA-TATE desde 2014, siempre siguiendo la guía de “Consenso de manejo de la terapia con péptidos marcados con radionúclidos (PRRT) en el tratamiento de tumores neuroendocrinos (TNEs)14”.
El objetivo ideal planteado cuando se administra esta terapia es la remisión completa de la enfermedad; sin embargo, este es un objetivo difícil de conseguir, por lo que la terapia se centra fundamentalmente en evitar la progresión, reducir los síntomas asociados a lesiones primarias y/o metastásicas, controlar la secreción hormonal y mejorar la calidad de vida de los pacientes.
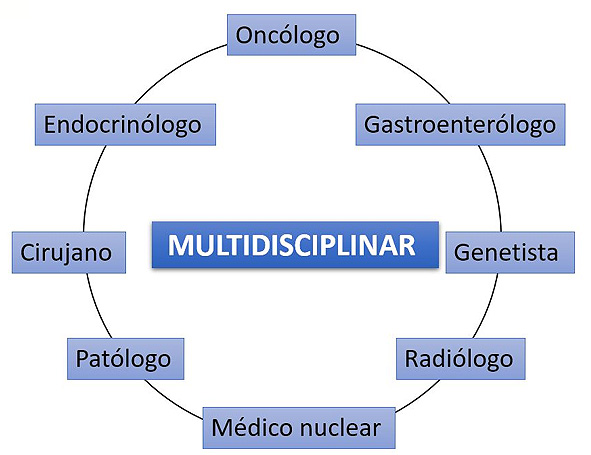
Es importante resaltar que siempre se debe plantear el tratamiento en el seno del comité multidisciplinar y que la correcta selección del paciente es lo que determina el éxito de esta terapia (ver Figura 2). Desde la experiencia práctica en el hospital La Fe, se seleccionan pacientes con TNE metastásicos o inoperables, que expresan receptores de la somatostatina, con un ECOG<2, y una expectativa de vida mayor a 6 meses.
El tratamiento completo con [177Lu]Lu-DOTA-TATE consiste en administrar 4 dosis fijas de 7,4 GBq, en un intervalo de 6-8 semanas. Antes de comenzar con el tratamiento, se retiran aquellos fármacos que pudieran aumentar las toxicidades.
El tratamiento con [177Lu]Lu-DOTA-TATE se administra en infusión lenta durante 30 minutos. Para disminuir en lo posible la radiación que reciben los riñones, se administra además, durante 270 minutos y empezando 30 minutos antes de la administración del radiofármaco, una infusión de aminoácidos que contiene L-lisina y L-arginina.
Dado que los efectos secundarios agudos (náuseas y vómitos) suelen ser causados por los aminoácidos, el paciente recibe de forma preventiva antieméticos y protectores gástricos 30 minutos antes de la solución de aminoácidos.
En el Hospital La Fe, el tratamiento con [177Lu]Lu-DOTA-TATE se ha administrado hasta el momento a 85 pacientes (42 hombres, 43 mujeres), con una mediana de edad de 60 años (20-81 años).
Los resultados obtenidos en esta serie de pacientes son extrapolables a los resultados obtenidos en el NETTER-1. En concreto, se obtuvo una supervivencia libre de progresión de 26,7 meses y una supervivencia global desde el tratamiento de 47,7 meses, con un tiempo de seguimiento promedio de 31 meses (4-90 meses).
En cuanto a la localización de los tumores primarios tratados en La Fe, el 20% fueron de origen intestinal; sin embargo, un 38.8% fueron de origen pancreático, un 18,8% pulmonar, 11,8% feocromocitomas y parangangliomas, 1,2% carcinoma de tiroides y 9,8% de origen desconocido, estos últimos no incluidos en la fase III del NETTER-1.
A pesar de ser pacientes de la práctica clínica habitual, la supervivencia libre de progresión y global (datos inmaduros) fueron similares a las reportadas en el NETTER-1 (que sólo incluía intestino medio). Por otro lado, el estado general, Ki67, sexo, tratamiento con everolimus y línea de tratamiento fueron predictores de supervivencia, mientras que la localización del tumor primario y la funcionalidad no lo fueron.
Aspectos prácticos en la terapia con radioligandos en Tumores Neuroendocrinos
Uno de los aspectos más importantes para optimizar este tipo de terapia es la selección del paciente.
El candidato ideal a la TRL debería cumplir las siguientes características:
• Confirmación de sobre-expresión de SSTR2 (KS 3-4)
• TNE-GEP metastásicos o inoperables en progresión
• TNE bien diferenciados, grado 1 y grado 2 (Ki67 < 20%)
• Estado general: Karnofky >50 o ECOG <2, esperanza de vida > 3 meses
• Suficiente reserva medular ósea
• Aclaramiento de creatinina > 50 ml/min
Una vez que el comité decide que el paciente es candidato, se solicita una primera visita a medicina nuclear, donde los médicos nucleares corroborarán que no existe ninguna contraindicación para el tratamiento, valorarán las analíticas del paciente, explicarán la indicación, la preparación previa, los posibles efectos secundarios derivados de la terapia y las medidas de radioprotección en el domicilio. Una vez obtenido el consentimiento informado, se programa el ingreso y se solicita la dosis de [177Lu]Lu-DOTA-TATE a la compañía suministradora con quince días de antelación.
Generalmente, tras una estancia de unas siete horas en el servicio de medicina nuclear, en salas especialmente preparadas, con paredes plomadas y con recogida selectiva de orina, los pacientes pueden ser dados de alta a domicilio, siendo las tasas de radiación a un metro de distancia menores de 40 microSv/hora. Solo en casos especiales (insulinomas y posibilidad de hipoglucemias, síndromes carcinoides funcionales severos, cardiopatías carcinoides severas…), los pacientes pasarán la noche en las habitaciones de medicina nuclear y serán dados de alta al día siguiente.
Preparación del paciente para la administración:
El día del tratamiento deberá acudir en ayunas de como mínimo seis horas y bien hidratado.
Deberá dejar de tomar 24 horas antes el tratamiento con análogos de somatostatina de vida corta (a excepción de tumores muy funcionantes donde a veces deben administrarse de forma profiláctica).
El paciente deberá presentar una funcionalidad renal hepática y hematológica mínima, de manera que los resultados bioquímicos deberán situarse en los valores de: aclaramiento de creatinina > 30ml/min, hemograma con Hb>8g/dl, Leucocitos > 2 x 10^3/ml y plaquetas > 75 x 10^3/ml).
Dentro de los efectos secundarios, existe el riesgo de afectación de la función renal. Por ello, para minimizar la dosis de radiación absorbida en los riñones, se le administrará una infusión en bomba de dos aminoácidos, L-lisina (25 gr) y L-arginina (25 gr), mencionados anteriormente.
Otro riesgo asociado es la toxicidad de la médula ósea y el descenso de las células sanguíneas (que controlaremos periódicamente), aunque en menos del 2% se ocasionan síndromes mielodisplásicos.
Como efecto inmediato, existe el riesgo de náuseas y vómitos, por lo que previamente a los aminoácidos y al tratamiento se administrarán antieméticos y protectores gástricos (30 minutos antes).
Otros efectos secundarios frecuentes son el dolor de cabeza y la exacerbación de los síntomas habituales uno o dos días post-tratamiento. Y a medio plazo, la astenia y la fragilidad del cabello asociada a discreta pérdida del mismo.
En cuanto a normas de radioprotección, se les explica que después de unas horas en el servicio de Medicina Nuclear se pueden ir al domicilio y hacer una vida normal, aunque tendrán que seguir una serie de normas referentes a la gestión de residuos (heces y sobre todo orina) y a la higiene, y que tendrán que evitar tener relaciones sexuales y contacto muy estrecho con mujeres embarazadas y menores de 5 años la semana posterior a la administración del radiofármaco.
Experiencia clínica en el Hospital Universitari Vall d’Hebron de Barcelona
En el Hospital Universitari Vall d’Hebron de Barcelona se inició la TRL en 2016 y desde entonces hemos tratado 72 pacientes de forma asistencial, sin contar pacientes incluidos en ensayos clínicos (29 mujeres, 42 hombres, edad media 59,2 años (22-85 años). 32 eran TNE primarios intestinales, 19 pancreáticos y 21 TNE otras localizaciones (pulmonares, gástricos, tímicos y paragangliomas). Para poder llevar a cabo la TRL en pacientes no GEP se debe solicitar autorización de medicación especial como uso compasivo.
Analizados los resultados de los 50 primeros pacientes, en todos ellos hubo una mejora de la calidad de vida y una disminución significativa de la sintomatología atribuible a la enfermedad. Ninguno de ellos tuvo toxicidad renal y solo dos de ellos debieron interrumpir el tratamiento por plaquetopenia.
25 obtuvieron respuesta parcial, 23 estabilidad y solo dos de ellos progresaron durante el tratamiento.
La supervivencia libre de progresión media fue de 21 meses (4-42 meses). 19 de los 50 fueron exitus (38%). Dicha mortalidad baja al 21% si los pacientes completan las cuatro dosis.
Un tratamiento con mucho futuro
La terapia con [177Lu]Lu-DOTA-TATE ha venido para quedarse en el tratamiento de los TNE. En la actualidad, hay muchos ensayos clínicos en marcha que buscan optimizar los resultados. Entre los más importantes, que pueden cambiar la práctica clínica a corto-medio plazo, se encuentra el COMPETE TRIAL, un estudio prospectivo, aleatorizado, controlado, abierto y multicéntrico de fase III para evaluar la eficacia y la seguridad de la terapia con radionúclidos de receptores peptídicos (PRRT) con [177Lu]Lu-DOTA-TOC en comparación con la terapia molecular dirigida con everolimus en pacientes con (TNE-GEP) inoperables, progresivos y con receptores de somatostatina positivos (SSTR+)15.
También se están desarrollando en estos momentos el NETTER-2, un estudio multicéntrico, aleatorizado y abierto de fase III para evaluar la eficacia y seguridad de [177Lu]Lu-DOTA-TATE en pacientes con TNE-GEP avanzado de G2 y G316; y el COMPOSE, un estudio prospectivo, aleatorio, controlado, abierto y multicéntrico para evaluar la eficacia, la seguridad y los resultados comunicados por los pacientes de la TRL con [177Lu]Lu-DOTA-TOC en comparación con el mejor tratamiento estándar en pacientes con TNE bien diferenciados, G2 y G3, con receptores de somatostatina positivos (SSTR+), de origen gastroentérico o pancreático17.
En la actualidad hay varios ensayos clínicos en marcha que nos ayudarán a resolver todas las dudas y controversias existentes, para llegar a un consenso más generalizado que el actual (En la reunión FOCUS3 de la EANM se vio que solo existía consenso en un 61% de cuestiones relacionadas con la PRRT). Estos ensayos son el COMPETE, el COMPOSE, el NETTER-2, el NETTER-P, el OCCLURANDOM, el LUTIA trial…
Para finalizar, es importante remarcar que, a pesar de la eficacia y la buena tolerabilidad de este tratamiento, hoy en día, muchos pacientes no tienen acceso a las TRLs. Según una encuesta realizada por INCA (International Neuroendocrine Cancer Alliance), hasta un 45% de los pacientes con TNE no tienen acceso a los radionúclidos, por lo que se debería asegurar que todos los pacientes tengan acceso a estos tratamientos en todo el territorio nacional.
Conclusiones
• La TRL es una buena estrategia terapéutica para pacientes con TNE inoperables o metastásicos.
• Incrementa la supervivencia libre de progresión, la supervivencia global y mejora la calidad de vida.
• Es un tratamiento bien tolerado, seguro y con efectos secundarios agudos generalmente leves y autolimitados.
• Se debe asegurar el acceso de nuestros pacientes a estos tratamientos en territorio nacional.
1. Del Olmo-García MI, Prado-Wohlwend S, Bello P, Segura A, Merino-Torres JF. Peptide Receptor Radionuclide Therapy with [177Lu]Lu-DOTA-TATE in Patients with Advanced GEP NENS: Present and Future Directions. Cancers (Basel). 2022 Jan 24;14(3):584. doi: 10.3390/cancers14030584. PMID: 35158852; PMCID: PMC8833790..
2. Eychenne R, Bouvry C, Bourgeois M, Loyer P, Benoist E, Lepareur N. Overview of Radiolabeled Somatostatin Analogs for Cancer Imaging and Therapy. Molecules. 2020 Sep 2;25(17):4012.
3. FT Lutathera® https://www.ema.europa.eu/en/documents/product-information/lutathera-epar-product-information_es.pdf
4. Label LUTATHERA®. Available online: https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/208700s000lbl.pd
5. Strosberg J, El-Haddad G, Wolin E, Hendifar A, Yao J, Chasen B, et al. NETTER-1 Trial Investigators. Phase 3 Trial of 177Lu-Dotatate for Midgut Neuroendocrine Tumors. N Engl J Med. 2017 Jan 12;376(2):125-135.
6. Del Olmo-García MI, Muros MA, López-de-la-Torre M, Agudelo M, Bello P, Soriano JM, et al. Prevention and Management of Hormonal Crisis during Theragnosis with LU-DOTA-TATE in Neuroendocrine Tumors. A Systematic Review and Approach Proposal. J Clin Med. 2020 Jul 12;9(7):2203.
7. Kwekkeboom DJ, Mueller-Brand J, Paganelli G, Anthony LB, Pauwels S, Kvols LK, et al. Overview of results of peptide receptor radionuclide therapy with 3 radiolabeled somatostatin analogs. J Nucl Med. 2005 Jan;46 Suppl 1:62S-6S.
8. Bodei L, Cremonesi M, Grana C, Rocca P, Bartolomei M, Chinol M, et al. Receptor radionuclide therapy with 90Y-[DOTA]0-Tyr3-octreotide (90Y-DOTATOC) in neuroendocrine tumours. Eur J Nucl Med Mol Imaging. 2004 Jul;31(7):1038-46.
9. Kwekkeboom DJ, Kam BL, van Essen M, Teunissen JJ, van Eijck CH, Valkema R, et al. Somatostatin-receptor-based imaging and therapy of gastroenteropancreatic neuroendocrine tumors. Endocr Relat Cancer. 2010 Jan 29;17(1):R53-73.
10. Brans B, Bodei L, Giammarile F, Linden O, Luster M, Oyen WJG, et al. Clinical radionuclide therapy dosimetry: the quest for the «Holy Gray». Eur J Nucl Med Mol Imaging. 2007 May;34(5):772-786.
11. Cremonesi M, Ferrari M, Di Dia A, Botta F, De Cicco C, Bodei L, et al. Recent issues on dosimetry and radiobiology for peptide receptor radionuclide therapy. Q J Nucl Med Mol Imaging. 2011 Apr;55(2):155-67.
12. Strosberg J, Caplin M, Kunz P, Ruszniewski P, Bodei L, Hendifar A, et al. Final overall survival in the phase 3 NETTER-1 study of lutetium-177-DOTATATE in patients with midgut neuroendocrine tumors. Journal of Clinical Oncology 2021 39:15_suppl, 4112-4112.
13. Strosberg J, Wolin E, Chasen B, Kulke M, Bushnell D, Caplin M, et al. NETTER-1 Study Group. Health-Related Quality of Life in Patients with Progressive Midgut Neuroendocrine Tumors Treated With 177Lu-Dotatate in the Phase III NETTER-1 Trial. J Clin Oncol. 2018 Sep 1;36(25):2578-2584.
14. Consenso de manejo de la terapia con péptidos marcados con radionúclidos (PRRT) en el tratamiento de tumores neuroendocrinos (TNEs). Avalado por el Grupo Español de Tumores Neuroendocrinos (GETNE) y por la Sociedad Española de Medicina Nuclear e Imagen Molecular (SEMNIM).
15. Efficacy and Safety of 177Lu-edotreotide PRRT in GEP-NET Patients (COMPETE). ClinicalTrials.gov Identifier: NCT03049189.
16. Study to Evaluate the Efficacy and Safety of Lutathera in Patients with Grade 2 and Grade 3 Advanced GEP-NET (NETTER-2). ClinicalTrials.gov Identifier: NCT03972488.
17. Lutetium 177Lu-Edotreotide Versus Best Standard of Care in Well-differentiated Aggressive Grade-2 and Grade-3 GastroEnteroPancreatic NeuroEndocrine Tumors (GEP-NETs) – COMPOSE (COMPOSE). ClinicalTrials.gov Identifier: NCT04919226.
(177Lu) oxodotreotida es la sustancia activa de [177Lu]Lu-DOTA-TATE
Nuevos datos en AR-EPID presentados en el congreso ACR 2023
También te puede interesar

Palopegteriparatida mejora la función renal en hipoparatiroidismo


